Alzheimer: laufende klinische Studien, State of the Art der Biomarkerdiagnostik und gemischte Pathologien
Bericht:
Dipl.-Ing. Dr. Manuel Spalt-Zoidl
Die Forschung an neuen Therapien für die Alzheimerkrankheit (AD) erfährt ein nie dagewesenes Momentum. Auf der internationalen Alzheimer- und Parkinsonkonferenz AD/PD in Wien gab es einen Überblick über die aktuellen klinischen Studien, über die Biomarkerdiagnostik und die Heterogenität der Pathologie.
Keypoints
-
Im aktuellen Jahr 2025 laufen 138 klinische Studien für die Behandlung von Alzheimer. Davon fallen 75% unter „drug-targeted therapies“ (DTT). 56 davon sind Phase-III-Studien.
-
Durch die Kombination von neuropsychologisch-klinischen Kriterien und Biomarkern ist eine Stadieneinteilung der Alzheimerkrankheit möglich, die eine Abschätzung der Progressionsgeschwindigkeit erlaubt.
-
Neuropathologische Post-mortem-Daten zeigen, dass Komorbiditäten bei der Alzheimerkrankheit weitverbreitet sind. Mehr als 40% zeigen eine a-Synuklein-Kopathologie und mehr als 50% eine TDP-43-Kopathologie.
Prof. Dr. Jeffrey Cummings, University of Nevada, Las Vegas, startete seinen Plenarvortrag mit Begeisterung: Mit 182 aktiven klinischen Studien werden im Jahr 2025 mehr Wirkstoffe für die Behandlung der AD untersucht als je zuvor. Außerdem werden Biomarker vermehrt und besser eingesetzt sowie innovativere Studiendesigns evaluiert.1Von 138 untersuchten Wirkstoffen richten sich drei Viertel auf dezidierte molekulare Targets und fallen unter den Begriff zielgerichtete Therapien (DTT). Cummings findet die Bezeichnung passender als den Ausdruck krankheitsmodifizierende Therapien.
Die Entwicklungspipeline für Arzneimittel zur Behandlung der AD
Ein Drittel der Wirkstoffe entfällt auf Moleküle, die für einen anderen Zweck bereits zugelassen sind, aber für die AD evaluiert werden. Der Rest umfasst Arzneimittel gegen neuropsychiatrische Symptome und kognitive „Enhancer“. Besonders erfreulich ist, so Cummings, dass viele zielgerichtete Biologika in Phase I vertreten sind und so höchstwahrscheinlich die Zukunft der Alzheimertherapie darstellen werden.1
Die molekularen Ziele der Alzheimertherapien werden anhand der 15 Kriterien der Common Alzheimer’s Disease Research Ontology (CADRO) in Kategorien eingeteilt. Anders als häufig angenommen, nehmen Studien zu Therapien gegen Beta-Amyloide(Aβ) mit 18% nicht die Mehrheit der Studien ein. Arzneimittel, die gegen Rezeptoren von Neurotransmittern oder Entzündungen gerichtet sind, sind mit 22% beziehungsweise 17% ähnlich häufig vertreten. Ebenso ist der Anteil an Studien gestiegen, die gegen Tau gerichtete Moleküle evaluieren.1
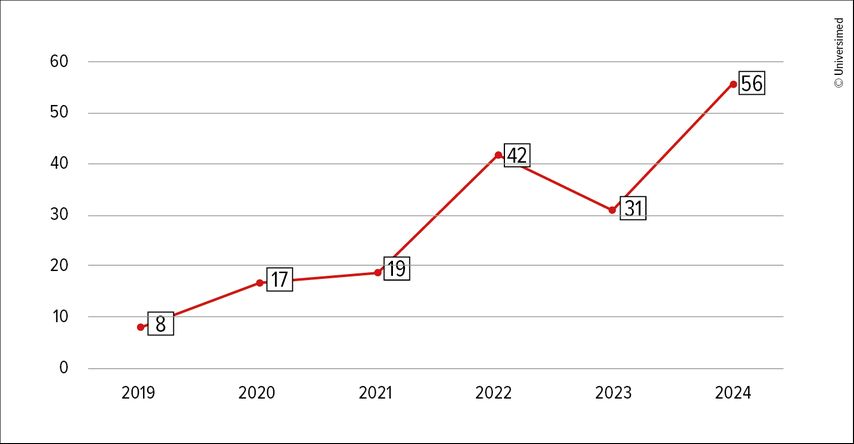
Der Vortragende betonte, dass im aktuellen Jahr 2025 ebenso viele Phase-III-Studien durchgeführt werden wie im Jahr 2024, die Anzahl der Phase-I-Studien sich jedoch fast verdoppelt hat. Auch die Gesamtanzahl der Phase-III-Studien ist von acht im Jahr 2019 auf 56 im Jahr 2024 gestiegen (Abb.1).1
Abb. 1: Anzahl durchgeführter Phase-III-Studien zwischen 2019 und 2024 (modifiziert nach Cummings et al.)1
Besonders überwältigend ist für Cummings die Anzahl der Patient:innen, die für klinische Studien benötigt werden. So müssen 50109 Patient:innen rekrutiert werden, um alle aktiven Studien durchführen zu können. Bei den meisten Studien muss zudem auch eine Begleitperson teilnehmen. Mit den Begleitpersonen, die meistens Angehörige sind, steigt die Gesamtzahl der Personen auf über 100000. Etwa 67% der Patient:innen nehmen an Phase-III-Studien teil, und dies über den gesamten Globus verteilt.1
Angesichts dieser Herausforderungen nimmt die Rekrutierung der Patient:innen häufig mehr Zeit in Anspruch als die Studie selbst. So dauert es durchschnittlich 138,3 Wochen, um Patient:innen für eine Studie mit Arzneimitteln gegen neuropsychiatrische Symptome zu rekrutieren. Die durchschnittliche Studienzeit beträgt jedoch nur 12,4 Wochen. Am ausgeglichensten sind dabei die Studien zu zielgerichteten Biologika. Hier steht einer Rekrutierungszeit von 116,8 Wochen eine Expositionszeit von 75,7 Wochen gegenüber.1
Neben der Wirksamkeit und Sicherheit pharmakologischer Therapien haben auch die Biomarker einen immer höheren Stellenwert. Für den Vortragenden ist klar, dass deren Berücksichtigung die Studiendauer und Arzneimittelentwicklung verkürzt, akkurate Diagnosen ermöglicht und dass sie zum Überwachen sicherheitsrelevanter Aspekte genutzt werden können. Heute sind Biomarker in 57% der Studien als Einschlusskriterien vorgesehen. Beispiele umfassen die Bestimmung von Aβ mit bildgebenden Verfahren wie Magnetresonanztomografie (MRT; 32%), Positronenemissionstomografie (PET; 26%) und Bestimmung von Biomarkern im Liquor oder Plasma mit 29%. Mit dem Hinweis, dass in 27% der Studien Biomarker auch als primäre Endpunkte eingesetzt werden, beendete Cummings seinen Vortrag.1
Biomarker als Schlüssel für Diagnose und Stadieneinteilung
Biomarker der AD können im Wesentlichen in drei Klassen unterteilt werden, berichtete Prof. Dr. Clifford Jack, Mayo Clinic, Rochester, Minnesota. Der Radiologe hat die Biomarkerdiagnostik der Alzheimerkrankheit geprägt und vorangetrieben wie wenige andere. Seine Schemata zum zeitlichen Verlauf der Alzheimerkrankheit basierend auf den biologischen und klinischen Merkmalen gehören zu den meistgezeigten Grafiken auf internationalen Alzheimerkonferenzen, sodass sie manchmal sogar schon als „Jack Curves“ referenziert werden.2
Die Biomarkerklassen umfassen erstens Marker, die unspezifisch für AD sind, jedoch an deren Pathophysiologie beteiligt sind. Als zweite Klasse gelten Biomarker einer nicht AD-typischen Kopathologie und als dritte die sogenannten Core-Biomarker, welche typisch für die AD-Pathologie sind. Je nachdem, zu welchem Zeitpunkt im Krankheitsverlauf die Biomarker nachgewiesen werden, werden sie weiter in Core-1 oder Core-2 unterteilt. Core-1 umfasse Biomarker, die hauptsächlich für die Diagnose der AD eingesetzt würden, betonte Jack. Beispiele seien Amyloid-PET, das Verhältnis von Aβ42 zu Aβ40, von phosphoryliertem Tau-181 (pTau181) zu Aβ42 oder Gesamt-Tau (tTau) zu Aβ42 im Liquor oder Plasma. Core-2 beinhaltet später nachweisbare Tau-Spezies wie die Microtubuli bindende Region von Tau (MTBR-Tau243) und nichtphosphorylierte Tau-Fragmente.3
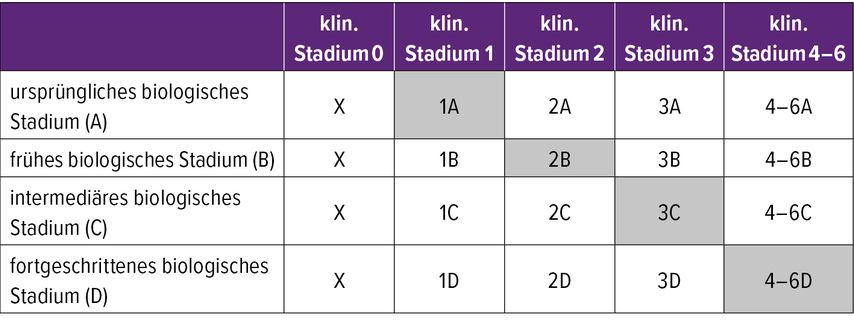
Ein weiterer Anwendungsbereich von Biomarkern ist die Beurteilung des Krankheitsstadiums. Hier wird grundsätzlich zwischen der biologischen und der davon unabhängigen klinischen Stadieneinteilung unterschieden. Während die klinische Beurteilung auf entsprechende Testbatterien wie die neuropsychologischen Tests des Consortium to Establish a Registry for Alzheimer’s Disease (CERAD) zurückgreift, wird die biologische Stadieneinteilung wiederum mithilfe der Core-1-Biomarker durchgeführt. Je nach Befund können vier biologische Stadien (A bis D) unterschieden werden. Stadium A umfasst Patient:innen mit einem positiven Nachweis von Amyloid und einem negativen Tau-Befund im jeweiligen PET. Stadium D ist dagegen mit einem positiven Amyloid-Befund und einem hohen neokortikalen Tau-Spiegel assoziiert. Die sechs klinischen Stadien reichen von Stadium 1, asymptomatische Patient:innen mit positivem Biomarkernachweis, bis Stadium 6, Patient:innen mit Demenz und starker funktioneller Einschränkung (Tab. 1).3
Tab. 1: Integrierte Stadienbeurteilung mithilfe von biologischen und klinischen Beurteilungen. Die grau hinterlegte Diagonale beschreibt einen typischen Verlauf der Alzheimerkrankheit (modifiziert nach Jack CR Jr et al.)3
Anhand der grau hinterlegten Diagonale in der tabellarischen Darstellung erkennt man Patient:innen, deren Krankheitsverlauf nur von der AD-Pathologie abhängt. Patient:innen, die sich in einem Stadium befinden, das oberhalb der Diagonale abgebildet ist, haben einen schnelleren Krankheitsverlauf, als durch die Biomarker erwartet werden würde. Bei diesen Patient:innen treten häufig überdurchschnittlich viele komorbide Pathologien wie die „limbic predominant age-related TDP-43 encephalopathy“ (LATE), die α-Synukleinopathie oder mikrovaskuläre Läsionen auf.3
Neuropathologische Beurteilung gemischter Pathologien
Zu komorbiden Pathologien und der Heterogenität erzählte Prof. Dr. Johannes Attems von der Newcastle University mehr: Komorbide Pathologien seien keine Seltenheit, eröffnete Attems seinen Vortrag. Tatsächlich tritt bei mehr als 40% der Patient:innen mit AD neben den typischen Aβ- und Tau-Spezies eine α-Synuklein-Kopathologie und in mehr als 50% der Fälle eine begleitende „TAR DNA binding protein 43“(TDP-43)-Pathologie auf. TDP-43 ist ein Protein, das in die Prozessierung der RNA involviert ist und bei diversen neurodegenerativen Erkrankungen wie ALS, frontotemporaler Demenz und Alzheimerdemenz akkumuliert vorkommt.4 Auch mikrovaskuläre Läsionen können bei mehr als 20% der AD-Patient:innen nachgewiesen werden. Umgekehrt tritt bei Demenz mit Lewy-Körperchen (LBD) in über 90% der Fälle auch eine Aβ- und in über 50% der Fälle eine Tau-Pathologie auf.5
Um die gemischten Pathologien zu klassifizieren, führten Attems und Kolleg:innen drei Kategorien ein. Patient:innen, deren Pathologien keine klinischen Symptome hervorrufen, werden Kategorie 1 zugeordnet. Kategorie 2 beschreibt Patient:innen mit einer deutlichen definierenden Pathologie des zugrunde liegenden Syndroms sowie einer begleitenden Pathologie ohne eigene Symptome. Als Beispiel nannte Attems eine neokortikale Lewy-Körperchen-Pathologie, welche für LBD kennzeichnend ist, und bei AD ein Braak-Stadium II. Die dritte Kategorie beschreibt eine gemischte Demenzform. Hier sind zwei oder mehr definierende Pathologien, wie zum Beispiel Braak-Stadium VI und neokortikale Lewy-Körperchen, gleichzeitig vorzufinden.5
Eine genaue Erfassung der gemischten Pathologien kann die Auswertung von Studienergebnissen in verschiedenen Subgruppen ermöglichen, welche wiederum die Entwicklung von Biomarkern, Studiendesigns und Einschlusskriterien beeinflussen. Gegenwärtig ist die genaue Erfassung der gemischten Pathologien allerdings nur post mortem möglich. Damit schloss Prof. Attems seine Ausführungen.5
Fazit
Die Entwicklung der Arzneimittel zur Behandlung der AD erfährt ein nie dagewesenes Momentum. Es herrscht ein klarer Trend zur Anwendung von zielgerichteten Biologika und zur Entwicklung neuer Diagnosekriterien mithilfe von Biomarkern. Diese sind nicht nur für die Diagnose selbst, sondern in Kombination mit einer klinischen Beurteilung auch für eine integrierte Erfassung des Krankheitsstadiums relevant. Die Auswertung von gemischten Pathologien ist zwar bisher nur post mortem möglich, könnte aber wesentlich zu einem innovativerem Studiendesign und der Entwicklung verbesserter Biomarker und Einschlusskriterien beitragen.
Quelle:
International Conference on Alzheimer’s and Parkinson’s Diseases and Related Neurological Disorders (ADPD), 1.–5. April 2025, Wien
Literatur:
1 Cummings J et al.: Alzheimer’s disease drug development pipeline: 2025. Alz&Dem: TRCI 2025. (in press) 2 Holmes D: Clifford Jack: biomarker curves and all that jazz. Lancet Neurology 2014; 13(10): 973 3 Jack CR Jr et al.: Revised criteria for diagnosis and staging of Alzheimer‘s disease: Alzheimer‘s Association Workgroup. Alzheimers Dement 2024; 20(8): 5143-69 4 Jo M et al.: The role of TDP-43 propagation in neurodegenerative diseases: integrating insights from clinical and experimental studies. Exp Mol Med. 2020; 52(10): 1652-62 5 Smith C et al.: Greenfieldʼs Neuropathology 10e Set (10th ed.). CRC Press 2024; 1216-25
Das könnte Sie auch interessieren:
Wichtige Laborparameter bei Epilepsie: ein aktueller Überblick
Laborkontrollen sind bei Epilepsien aus verschiedensten Gründen erforderlich. Anfallssupprimierende Medikamente können Störwirkungen auf unterschiedliche Organsysteme haben, die unter ...
Schlafbezogene Bewegungsstörungen: Was ist bekannt, was ist neu?
Schlafbezogene Bewegungsstörungen sind eine heterogene Krankheitsgruppe. Viele Krankheitsbilder treten nur selten auf. Einige wie die periodischen Beinbewegungen im Schlaf („periodic ...
Highlights zu neurodegenerativen Erkrankungen vom EAN-Kongress
Prof. Dr. Elena Moro, Präsidentin der European Academy of Neurology (EAN), eröffnete den elften Kongress der Vereinigung in Helsinki. Führende Expert:innen verschiedener Fachrichtungen ...