Zunehmende therapeutische Optionen bei kardialer Amyloidose
Bericht: Reno Barth
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Während der Erkrankungsverlauf einer kardialen Amyloidose noch vor rund einem Jahrzehnt schicksalhaft, progredient und therapeutisch nicht beeinflussbar war, so stehen heute mehrere Amyloid-spezifische Therapien zur Verfügung. Einige sind bereits zugelassen oder haben die Phase-III-Studien erfolgreich durchlaufen. Ein relevantes Problem im klinischen Alltag dürften künftig die hohen Kosten dieser Therapien werden.
Keypoints
-
Bei der ATTR-CM kommt es zur Ablagerung von abnormen Transthyretin-Varianten im Herzen.
-
Für die Wirksamkeit konventioneller Herzinsuffizienztherapien bei ATTR-CM gibt es keine Evidenz aus prospektiven Studien.
-
Seit der Zulassung von Tafamidis in der Indikation ATTR-CM wurden mittlerweile weitere Amyloid-spezifische Therapien in Studien erfolgreich eingesetzt.
-
Die ESC liefert in ihrer aktuellen Leitlinie zu Kardiomyopathien detaillierte Empfehlungen zur Diagnostik der Herzinsuffizienz infolge kardialer Amyloidose.
Bei der kardialen Amyloidose handelt es sich um eine progrediente infiltrative Kardiomyopathie, die durch die Ablagerung fehlgefalteter Proteine im Interstitium des Myokards mit entsprechender Myokardhypertrophie gekennzeichnet ist. Die Folge ist eine Störung der diastolischen und später auch der systolischen Linksventrikelfunktion, die sich klinisch als Herzinsuffizienz mit Belastungsdyspnoe, Beinödemen und rascher Erschöpfbarkeit äußert. Die wichtigsten Formen sind die häufig mit Non-Hodgkin-Lymphomen assoziierte Leichtketten(AL)-Amyloidose und die Transthyretin(ATTR)-Amyloidose. Letztere entsteht durch die Ablagerung von abnormen Varianten des Transportproteins Transthyretin im Herzen.
„Die Therapiemöglichkeiten bei kardialer Amyloidose haben sich in den vergangenen 10 Jahren drastisch verändert“, erläutertPriv.-Doz. Dr. Franz Duca, Medizinische Universität Wien, und hebt hervor, dass seit einigen Jahren Amyloid-spezifische Therapien zur Verfügung stehen, mit denen sich kausal in den Krankheitsverlauf eingreifen lässt. Daneben sollten auch die konventionellen Herzinsuffizienztherapien bei kardialer Amyloidose nicht völlig vergessen werden.
Sehr schwache Evidenz für konventionelle Therapien
Hinsichtlich der konventionellen Therapien legt eine retrospektive Analyse von mehr als 2000 Patient:innen mit kardialer ATTR-Amyloidose nahe, dass Mineralokortikoidrezeptor-Antagonisten (MRA) sowohl in der Gesamtpopulation als auch in einer Subgruppe mit einer linksventrikulären Auswurffraktion (LVEF) <40% mit reduzierter Mortalität assoziiert waren. Niedrig dosierte Betablocker reduzierten die Sterblichkeit nur bei Patient:innen mit LVEF <40%. Für die RAAS-Blockade mit ACE-Hemmern (ACEi) oder Angiotensin-Rezeptorblockern (ARBs) konnte hingegen keine Reduktion der Mortalität nachgewiesen werden. ACEi/ARBs wurden auch häufiger abgesetzt als die anderen untersuchten Substanzen.1 Eine kleinere Studie mit Patient:innen mit ATTR-Kardiomyopathie zeigte unter Therapie mit Betablockern sogar eine Reduktion des Mortalitätsrisikos in der Größenordnung von 70%. Allerdings mussten 25% der Patient:innen die Therapie wegen Unverträglichkeit abbrechen.2 Da es sich hier durchwegs um retrospektive Daten handle, können diese Arbeiten jedoch bestenfalls als hypothesengenerierend gewertet werden, erläutert Duca. Generell bewege man sich bei den supportiven Therapien in einer „evidenzfreien Zone“. Hinweise für Betablocker und MRA müssten daher mit dem Zusatz einer „möglicherweisen“ Wirksamkeit versehen werden. Ebenso gibt es Hinweise auf eine Senkung der Mortalität durch SGLT2-Hemmer (SGLT2i), für die ebenfalls ausschließlich retrospektive Daten vorliegen.3
Für Schleifendiuretika wurde eine Assoziation von höheren Dosierungen mit erhöhter Mortalität gezeigt. „Dies erklärt sich aus dem schlichten Umstand, dass kränkere Patient:innen mehr Diuretika benötigen“, so Duca. In der klinischen Praxis könne ein steigender Diuretikabedarf als einfacher Indikator für eine Verschlechterung der Krankheit gewertet werden. Nicht übersehen werden darf, dass bei Amyloidose generell ein deutlich erhöhtes und vom CHA2DS2-VASc-Score unabhängiges Thromboserisiko, das auch unter Antikoagulation hoch bleibt, vorliegt. Ebenso treten bei mehr als der Hälfte der Betroffenen Arrhythmien auf. Zu einem möglichen Einfluss auf das Überleben fehlen allerdings die Daten.
Kausale Therapien bei ATTR-Amyloidose bereits im Einsatz
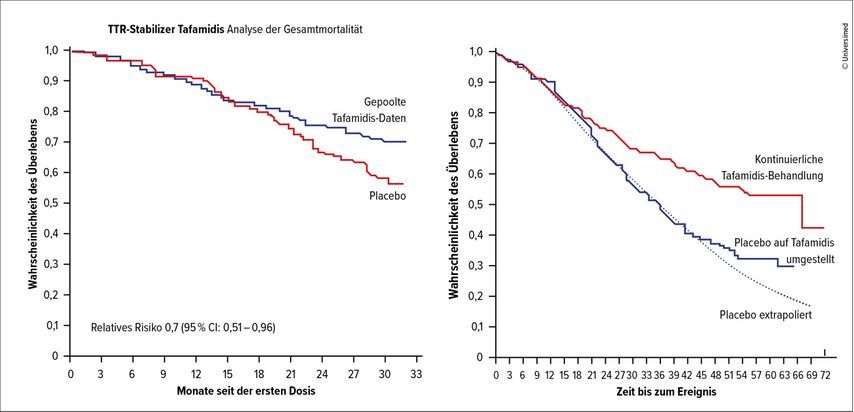
Das Feld der Amyloid-spezifischen Therapien hat sich in nur etwas mehr als einem Jahrzehnt rasant entwickelt. Eine Möglichkeit zur Behandlung der Transthyretin(ATTR)-Amyloidose bietet der TTR-Stabilizer Tafamidis, der die Dissoziation des TTR in Monomere verhindert. Die Phase-III-Studie ATTR-ACT mit Tafamidis begann 2013 und zeigte im Vergleich zu Placebo einen signifikanten Überlebensvorteil mit Verbesserung der Lebensqualität. Der Einsatz in frühen Krankheitsstadien dürfte vorteilhaft sein, da die Patient:innen aus der Placebogruppe von einer Umstellung auf Tafamidis zwar profitierten, der bereits entstandene Nachteil jedoch nicht mehr aufgeholt werden konnte. Weiters betont Duca, dass in ATTR-ACT die Placebo- und Verumkurven erst nach rund 18 Monaten auseinandergingen(Abb. 1). Man müsse die Patient:innen daher informieren, dass mit keiner schnellen Wirkung zu rechnen ist. ATTR-ACT führte 2019 zur Zulassung von Tafamidis.4
Abb. 1: Wahrscheinlichkeit für das Überleben unter Tafamidis (modifiziert nach Maurer MS et al. 2018)4
Ein weiterer TTR-Stabilisator ist Acoramidis, für das ex vivo eine TTR-Stabilisierung von mehr als 90% gezeigt werden konnte. In der Zulassungsstudie ATTRibute-CM reduzierte Acoramidis mehrere kombinierte Endpunkte, die unter anderem die Punkte Gesamtsterblichkeit, Hospitalisierungen aus kardiovaskulären Gründen sowie Verschlechterung im 6-Minuten-Gehtest und Veränderung des NT-proBNP-Spiegels umfassten, signifikant und deutlich.5
Eine weitere Strategie zur Behandlung der TTR-Amyloidose ist die pharmakologische Hemmung der TTR-Synthese in der Leber. Dafür wurden das Antisense-Molekül Inotersen und die „small interfering RNA“ (siRNA) Patisiran entwickelt, die, ebenso wie die siRNA Vutrisiran, in der Indikation ATTR-assoziierte Neuropathie zugelassen sind.
In der Indikation AL-Amyloidose wurde Daratumumab, ein humaner monoklonaler Antikörper gegen CD38, ein Glykoprotein, das unter anderem auf den Oberflächen von Plasmazellen exprimiert wird, in der ANDROMEDA-Studie untersucht. Im Vergleich zu Placebo führte Daratumumab zu besserem hämatologischem Ansprechen sowie zu einer Reduktion von Organschäden.6
Gute Daten für siRNA Vutrisiran auch bei kardialer ATTR-Amyloidose
Vutrisiran wurde auch bereits in der Indikation Transthyretin-Amyloidose mit Kardiomyopathie untersucht. Die Studie HELIOS-B zeigte statistische Signifikanz bei primären und allen sekundären Endpunkten sowohl in der Gesamt- als auch in der Monotherapiepopulation – also bei Patient:innen, die bei Einschluss nicht mit Tafamidis behandelt wurden. Die Reduktionen der Gesamtmortalität und der wiederkehrenden kardiovaskulären Ereignisse lagen bei 28% in der Gesamt- und bei 33% in der Monotherapiepopulation. Auch die Abnahme der 6-Minuten-Gehstrecke und des KCCQ-OS(Kansas City Cardiomyopathy Questionnaire Overall Summary)-Score wurde durch Vutrisiran signifikant gebremst. Duca betont, dass 40% der Population von HELIOS-B bereits unter Therapie mit Tafamidis standen, und weist insbesondere auf die Reduktion von Hospitalisierungen hin, die von vielen der zumeist betagten Betroffenen subjektiv als wichtiger empfunden wird als die reine Lebensverlängerung.7
Über die Jahre zeigt sich in den Studien eine generell verbesserte Prognose der Erkrankung. Die Placebogruppe von HELIOS-B hatte verglichen mit der Verumgruppe von ATTR-ACTein besseres Outcome, was vor allem daran liegt, dass Patient:innen mit ATTR-Kardiomyopathie heute früher diagnostiziert und behandelt werden. „Es sind nicht mehr die Patient:innen, wie wir sie vor zehn Jahren gesehen haben“, so Duca. Dementsprechend sei es schwierig, die Wirksamkeit der ersten für die ATTR-Amyloidose zugelassenen Therapien mit den neueren Substanzen zu vergleichen.
Mögliche Zukunft: Genschere, Depleter und hoheBehandlungskosten
Eine Zukunftshoffnung auf diesem Gebiet ist eine auf der Genschere CRISPR-Cas9 beruhende Therapie, die die Amyloid-Ablagerung vollständig zum Sistieren bringen könnte. Studien am Menschen laufen. Mit einer einzigen Applikation der „Gene-editing“-Therapie NTLA-2001 konnten die Serumspiegel von TTR um rund 90% gesenkt werden.8 Ein weiterer innovativer Ansatz besteht in einer Verbesserung des Abbaus von abgelagertem Amyloid. Mehrere Depleter mit unterschiedlichen Wirkmechanismen werden bereits in Studien am Menschen untersucht. Im Falle von Zulassungen werden sich neue Möglichkeiten für Kombinationstherapien bzw. sequenzielle Therapien ergeben.
„Ein erhebliches Problem werde in Zukunft die Kostenfrage darstellen. Bereits Tafamidis war das mit Abstand teuerste Medikament, das wir jemals hatten“, so Duca. Die in der Neurologie bereits verwendeten neueren Substanzen sind noch erheblich teurer. Diese Preise können realisiert werden, da die Amyloidosen von den Zulassungsbehörden als seltene Erkrankungen eingestuft werden. Ob sich diese Einschätzung in Zukunft halten kann, ist fraglich, und es bestehe die Gefahr, dass in Zukunft Betroffenen diese effektive Therapie aus Kostengründen verwehrt wird.
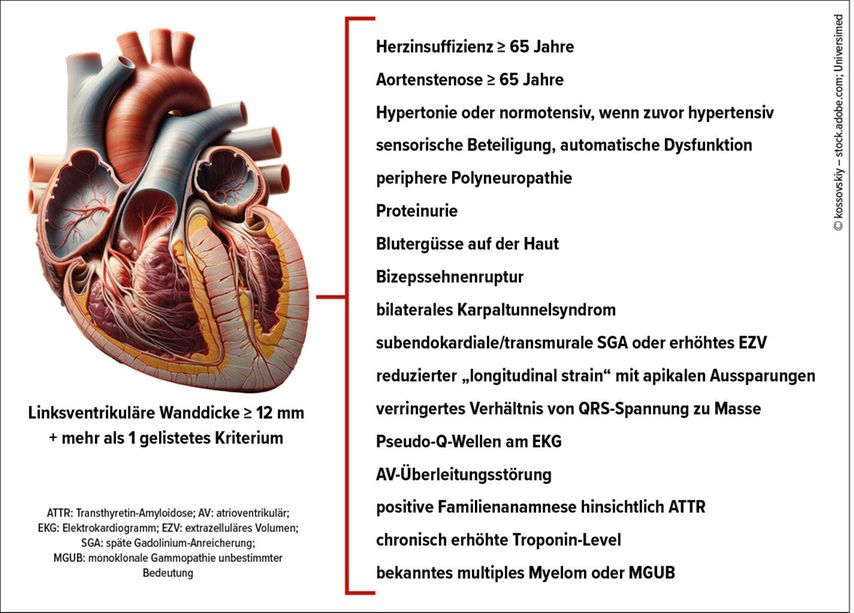
In diesem Zusammenhang weist Priv.-Doz. Dr. Andreas Kammerlander von der Medizinischen Universität Wien auf das Fehlen einer allgemein akzeptierten Definition von seltenen Erkrankungen hin. Zumeist bezeichne man Erkrankungen unter einer Prävalenz von 1:2000 als selten. Damit sind seltene Herzerkrankungen nicht so selten, wie man meinen könnte. Beispielsweise fällt laut Orphanet der kardiogene Schock in diese Kategorie. Seit 2023 finden die seltenen Erkrankungen auch erstmals explizit Berücksichtigung in den Leitlinien der ESC. Unter anderem wird ausführlich auf kardiale Amyloidosen eingegangen und ein empfohlener Diagnosepfad angegeben, der für die ATTR-Amyloidose auch nichtinvasive Diagnostik vorsieht (Abb. 2). Die Leitlinie hebt auch das Fehlen von Evidenz für den Einsatz konventioneller Herzinsuffizienzmedikamente bei kardialer Amyloidose hervor. Für die ATTR-Amyloidose werden die Stabilisierung von Transthyretin sowie die Reduktion von dessen Produktion empfohlen. Dies bedeutet eine Empfehlung für Tafamidis, das möglichst früh im Krankheitsverlauf (bei NYHA-Klasse I und II) eingesetzt werden soll. Daneben finden Patisiran und Inotersen bereits Erwähnung, mit dem Zusatz, dass aktuell eine Zulassung nur bei ATTR-assoziierter Polyneuropathie mit oder ohne Kardiomyopathie besteht.
Quelle:
Vortrag „Rare diseases“ in der 7. Hauptsitzung des Wiener Kongresses für Kardiologie am 19.Oktober 2024 in Wien
Literatur:
1 Ioannou A et al.: Conventional heart failure therapy in cardiac ATTR amyloidosis. Eur Heart J 2023; 14; 44(31): 2893-907 2 Barge-Caballero G et al.: Beta-blocker exposure and survival in patients with Transthyretin amyloid cardiomyopathy. Mayo Clin Proc 2022; 97(2): 261-73 3 Porcari A et al.: SGLT2 inhibitor therapy in patients with Transthyretin amyloid cardiomyopathy. J Am Coll Cardiol 2024; 83(24): 2411-22 4 Maurer MS et al.: Tafamidis treatment for patients with Transthyretin amyloid cardiomyopathy. N Engl J Med 2018; 379(11): 1007-16 5 Gillmore JD et al.: Efficacy and safety of Acoramidis in Transthyretin amyloid cardiomyopathy. N Engl J Med 2024; 390(2): 132-42 6 Kastritis E et al.: Daratumumab-based treatment for immunoglobulin light-chain amyloidosis. N Engl J Med 2021; 385(1): 46-58 7 Fontana M et al.: Vutrisiran in patients with transthyretin amyloidosis with cardiomyopathy. N Engl J Med 2025; 392(1): 33-44 8 Gillmore JD et al.: CRISPR-Cas9 in vivo gene editing for Transthyretin amyloidosis. N Engl J Med 2021; 385(6): 493-502 9 Arbelo E et al.: 2023 ESC Guidelines for the management of cardiomyopathies. Eur Heart J 2023; 44(37): 3503-626
Das könnte Sie auch interessieren:
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
Mechanische Kreislaufunterstützung im Infarkt-bedingten kardiogenen Schock
Der Infarkt-bedingte kardiogene Schock (AMI-CS) ist trotz der enormen Fortschritte in der interventionellen Versorgung des akuten Myokardinfarktes in den vergangenen Jahrzehnten ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...